您的浏览器太旧了,请更新您的浏览器X
肿瘤
近些年多发性骨髓瘤(MM)的治疗取得了令人瞩目的进展,特别是2015年,美国食品药品监督管理局(FDA)批准了多个新药治疗复发难治MM(RRMM)。2015年美国血液学会(ASH)年会将2016年命名为"MM治疗进步年"。因此在丹麦哥本哈根举办的第21届欧洲血液学会(EHA)年会上,关于MM的议题得到了与会各国专家学者的广泛关注。
一、抗CD38单克隆抗体
1. daratumumab
daratumumab是一种IgG1k抗体,也是首个人源化抗CD38单克隆抗体,具有广谱杀伤活性。daratumumab作为抗CD38 IgGκ的单克隆抗体,与MM细胞表面高度表达的跨膜胞外酶CD38分子结合后,主要通过补体依赖性细胞毒性反应(CDC)、细胞介导的细胞毒作用(ADCC)、抗体介导的细胞吞噬作用(ADCP)和凋亡途径促进MM细胞的死亡。早期的研究显示,daratumumab单药治疗RRMM取得了令人鼓舞的疗效,且安全性良好。在2015年的ASH年会上,Plesner等报道了daratumumab联合来那度胺和地塞米松(DRD)治疗MM的Ⅰ/Ⅱ期试验结果,患者可获得快速、深度且持久的缓解,并且安全性好。本次EHA年会上,有研究者分别报道了daratumumab联合治疗RRMM的Ⅲ期研究结果。这两个研究均被评为EHA最佳研究。
CASTOR研究是一项随机对照的Ⅲ期临床研究,旨在比较daratumumab+硼替佐米+地塞米松的联合方案(DVd)与硼替佐米+地塞米松(Vd)方案在RRMM患者中的有效性和安全性。共纳入498例至少接受过1种方案一线治疗的RRMM患者,按1∶1随机分为DVd组(251例)和Vd组(247例),接受8个疗程的治疗。主要研究终点是无进展生存(PFS)。所有患者入组前均接受至少2种或以上的一线治疗方案。中位随访时间7.4个月,daratumumab的加入使得DVd组PFS优于Vd组(未达到比7.2个月),并且降低疾病进展和死亡的风险。DVd组中位疾病进展时间(TTP)也优于Vd组(未达到比7.3个月),并且DVd组患者的总缓解率(ORR)(83%比63%)、非常好的部分缓解(VGPR)率(59%比29%)和完全缓解(CR)率(19%比9%)同样高于Vd组。DVd组、Vd组中位持续缓解时间分别为未出现、7.9个月。不同亚组中接受Dvd方案治疗患者的PFS均优于Vd方案。在安全性方面,DVd和Vd组最常见(>25%)的治疗相关不良反应(TETA)主要包括血小板减少(59%比44%)、周围神经病变(47%比38%)、腹泻(32%比22%)和贫血(26%比31%)。其中,较常见的3、4级不良反应(>10%)为血小板减少(45%比33%)、贫血(14%比16%)、中性粒细胞减少(13%比4%)。
POLLUX研究也是一项随机、多中心Ⅲ期临床研究,目的是比较daratumumab联合DRD与来那度胺及地塞米松(RD)在RRMM患者中的有效性及安全性。569例接受过一线以上治疗的RRMM患者进入该研究,按照1∶1随机接受DRD或RD方案治疗。其中,来那度胺25 mg(第1天至第21天,每28 d为1个疗程);地塞米松40 mg(每周1次);daratumumab 16 mg/kg(每周1次,共8周,此后每2周1次,共16周,随后每4周1次,直到疾病进展)。主要研究终点为PFS,次要研究终点为TTP、ORR、VGPR、微小残留病(MRD)阴性比例、总生存(OS)、反应持续时间(DOR)及安全性。所有患者进入临床研究前均接受了至少一种方案的治疗。有效性方面,中位随访13.5个月,daratumumab能明显延长RRMM患者的中位PFS,DRD组为未达到,RD组为18.4个月,与RD组相比,DRD组降低了63%疾病进展或死亡的风险。DRD能明显延长TTP,RD组预期TTP为18.4个月,而DRD组未达到。而且DRD组患者的ORR(93%比76%)、VGPR(76%比44%)和CR(43%比19%)同样优于RD组。两组DOR分别为未达到与17.4个月。同样,在不同亚组中接受DRD方案治疗患者的PFS也均优于RD方案组。安全性方面,DRD和RD组最常见(>25%)TETA主要有中性粒细胞减少、腹泻、乏力、上呼吸道感染、血小板减少、肌肉痉挛。最常见的3、4级不良反应为中性粒细胞减少、血小板减少和贫血。两组3、4级感染发生率分别为28%和23%。两组因为不良反应终止治疗比例相当,分别为7%和8%。daratumumab注射的TETA发生率为48%,绝大多数为1、2级,92%发生在第1次注射时。
这两个研究显示,包含daratumumab的联合治疗方案能够诱导深层次的和长期的维持,降低疾病进展及死亡的风险,并且不良反应是可控的。daratumumab联合方案为RRMM患者提供了更新的选择,具有良好的应用前景。
2. isatuximab(ISA)
ISA是人源化抗CD38单克隆抗体,能够通过直接介导靶向肿瘤细胞与免疫细胞的接触等多种方式杀伤肿瘤细胞。在本次EHA年会上,ISA单药治疗RRMM的最新数据显示,接受超过10 mg/kg剂量的患者总有效率为24%,并且耐受性良好。较早的研究发现,ISA(10 mg/kg,2次/周)联合RD时的总有效率可高达63%。
在本次EHA年会上,研究者报告了ISA另外两个更高剂量组的初步结果,共26例患者进入研究,中位年龄65岁,ISA剂量为10或20 mg/kg,1次/周,共4次,然后1次/2周。来那度胺的剂量为25 mg/d(第1天至第21天),地塞米松的剂量为40 mg/d(第1、8、15、22天),28 d为1个周期。截至2015年12月,10 mg/kg组中位持续治疗时间为21.5个月,20 mg/kg组中位持续治疗时间为9.9个月。13例患者仍继续接受治疗,20 mg/kg组中,4例患者在第1个疗程因不良事件、3例因3级输液相关反应、1例因3级肺炎而停止治疗。最常见的不良反应包括乏力(46%)、发热(35%)、腹泻(31%)。65%的患者出现TETA,大多为2级,且超过90%发生在第1个疗程。没有发现最大耐受剂量。在可评价的患者中两个剂量组ORR均为50%,10 mg/kg组(12例)VGPR率25%,部分缓解(PR)率25%;20 mg/kg组(12例)VGPR率20%,PR率30%。两组临床收益率为83%。这两个研究表明该药对RRMM有较好的活性,需要更多的临床研究进一步评价有效性和安全性。
3. MOR202
MOR202是另一个人IgG1型抗CD38单克隆抗体,具有更强的ADCC和ADCP,而不出现CDC,因此TETA发生率更低。临床前研究发现,MOR202单药有很高的活性,与免疫调节剂,如来那度胺或泊马度胺(POM)具有协同作用。
本届EHA年会上,Raab等报道了MOR202单药及联合来那度胺或泊马度胺治疗RRMM的剂量递增的Ⅰ/Ⅱa期研究结果。MOR202单药有3个剂量组:4、8、16 mg/kg,联合组MOR202剂量为8 mg/kg和16 mg/kg。截至2016年1月29日,MOR202单药组11例患者,MOR20联合来那度胺组5例患者,MOR20联合泊马度胺组4例患者接受了治疗。MOR202单药组可评价的10例患者中3例有效,MOR20联合来那度胺组可评价的4例中3例患者达到了PR,MOR20联合泊马度胺组4例可评价的患者中2例获得缓解。这8例获得缓解的患者中7例仍然保持缓解,其中1例缓解时间超过了10个月。安全性方面,无论是单药组还是联合治疗组,所有患者均耐受性良好,没有患者出现与MOR202相关的治疗中断或死亡。
这些研究显示,抗CD38单克隆抗体与免疫调节剂联合应用具有较好的协同效应,不仅可以诱导深度的缓解,而且可以维持缓解的持久性。为对蛋白酶体抑制剂和(或)免疫调节剂耐药的患者提供了有效的治疗策略,具有良好的应用前景。
CD38分子在MM细胞上高表达,因此,针对其构建抗CD38的嵌合抗原受体T细胞(CAR-T)治疗MM是非常有前途的治疗手段之一。有报道显示,CAR-T治疗RRMM取得了惊人的疗效。另外PD-1抑制剂治疗RRMM的相关研究已经启动,已有报道应用现在已批准的PD-1抑制剂治疗RRMM患者,单药有效率只有18%,但与新药联合可能是治疗RRMM的有效方法之一。
二、二代蛋白酶体抑制剂
1. 卡非佐米(carfilzomib)
第一代蛋白酶体抑制剂硼替佐米显著改善了MM患者的预后,但是由于近40%的患者不能耐受该药的不良反应,而且大多数患者最终会对硼替佐米出现耐药,因此新型蛋白酶体抑制剂应运而生。卡非佐米是第一个被批准的二代蛋白酶体抑制剂。早期的研究显示卡非佐米单药及联合免疫调节剂或烷化剂或激素治疗RRMM患者均具有非常好的疗效和安全性。
在本次EHA年会上,Leleu等[9]报告了IFM2012-03的研究结果,该研究是Ⅰ/Ⅱ期多中心、开放的单臂研究。卡非佐米采用剂量递增的周疗法,剂量分别为36、45、56、70 mg/m2,第1、8、15、22天;联合美法仑(0.25 mg/kg)和泼尼松(60 mg/m2),均在第1天至第4天口服。9个疗程的诱导治疗结束后,给予36 mg/m2,1次/2周,共1年的维持治疗。32例初治MM患者进入研究,30例接受治疗,中位年龄为76岁。ORR为87.5%,33%获CR。中位随访12个月,1例患者疾病进展,1例患者死于卡非佐米相关的不良反应。2例患者终止治疗,共200个治疗周期中,报告了22例严重不良事件。另外有3例患者减少了卡非佐米的用量。
同时,Bringhen等也报告了卡非佐米联合环磷酰胺及地塞米松周疗法(wKCyd)治疗初治MM患者,以及卡非佐米维持治疗的Ⅰ/Ⅱ期研究的初步结果,共54例患者进入研究。在诱导治疗阶段ORR为88%,VGPR率71%,CR率12%。在29例可评价的维持治疗的患者中,中位维持治疗时间为14.5个月,7例患者缓解程度进一步提高。在维持治疗阶段,ORR为95%,1年PFS率为79.4%。10例患者因不良反应而停止治疗。常见不良反应有贫血、血小板减少、中性粒细胞减少以及恶心呕吐。该研究显示wKCyd疗法中,加卡非佐米维持治疗表现出了非常好的安全性和有效性,可提高缓解程度,并获得更深层的缓解。
2. ixazomib
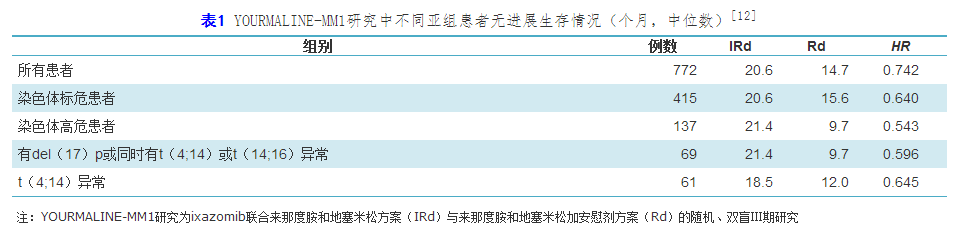
ixazomib是另外一个最近被批准用于治疗RRMM的二代蛋白酶体抑制剂。2015年ASH年会上,Moreau等报告了ixazomib联合来那度胺和地塞米松方案(IRd)与来那度胺和地塞米松加安慰剂方案(Rd)的随机、双盲Ⅲ期研究的初步结果,IRd方案较Rd方案显著提高PFS率。本次EHA年会上,更新了该研究在具有高危染色体异常患者中有效性和安全性的数据。共纳入722例RRMM患者,其中137例具有高危染色体变化,IRd组75例,Rd组62例。经过中位15个月的随访,无论在染色体高危患者还是在标危患者中,IRd方案均提高患者的FPS率。在高危患者中,IRd组的PFS与所有患者或标危患者相似,不同高危染色体患者均能从IRd方案中获益(表1)。在ORR方面,高危患者中IRd组为79%,Rd组为60%,标危患者中IRd组为80%,Rd组为73%。截至数据统计时,高危患者IRd组死亡率11%,Rd组死亡率21%,标危患者IRd组死亡21率11%,Rd组为率15%。还有研究显示,在来那度胺和地塞米松的基础上增加ixazomib对患者的生命质量没有影响,而且IRd方案还能使患者获得更好的临床收益,明显改善患者的预后。
表1 YOURMALINE-MM1研究中不同亚组患者无进展生存情况(个月,中位数)
3. opozomib
opozomib是新型强效、可口服的二代蛋白酶体抑制剂,其结构与卡非佐米类似。临床前研究发现,opozomib具有抗骨髓瘤细胞的活性。较早的研究证实该药对RRMM患者有效。
在本次EHA年会上Shah等报告了opozomib联合泊马度胺和地塞米松(OPOMD)治疗RRMM患者Ⅰb期的初步研究结果。该研究的目的是确定最大耐受剂量,推荐Ⅲ期试验的剂量,以及评价安全性和耐受性。次要目标是观察总有效性、临床收益率和opozomib的药代动力学参数。opozomib给药方案分为两种:双周5 d方案(5/14方案:第1天至第5天,第15天至第19天)起始剂量150 mg/d,单周2 d方案(2/7方案:第1、2、8、9、15、16、22、23天)起始剂量210 mg/d。泊马度胺剂量均为4 mg/d(第1天至第21天),地塞米松20 mg/d(2/7方案:第1、2、8、9、15、16、22、23天)。共21例RRMM患者进入研究,5/14方案和2/7方案分别出现2例和1例剂量限制性毒性(DLT),两个剂量组分别有1例患者因不良反应而退出研究。2/7方案中接受210 mg/d opozomib的患者以及接受240 mg/d opozomib的患者中分别有71%和50%的患者获得PR以上的缓解。5/14方案中也有50%的患者获得PR以上的缓解。每个剂量组均未出现最大耐受剂量。该研究表明,OPOMD方案在多次耐药的患者中有显著的抗骨髓瘤活性,并且耐受性良好。
三、自体造血干细胞移植(ASCT)
尽管新药显著改善了患者的预后,但是ASCT在MM的治疗中仍有着至关重要的作用。诱导方案治疗后,行ASCT后再采用维持治疗的治疗模式,目前已经被广泛采用。虽然诱导方案及维持治疗方案存在差异,但ASCT后均显著提高了患者的OS率和PFS率。
本次EHA年会上,多名学者报告了这方面的最新研究结果。Jakubowiak等比较初治MM患者给予卡非佐米联合来那度胺和地塞米松(KRd)方案治疗4个疗程后,给予ASCT,此后再给予KRd巩固治疗4个疗程,卡非佐米减量维持治疗10个疗程,与既往仅采用KRd方案的历史数据进行对比。76例患者进入KRd+ASCT研究,可评价72例,截至2016年1月1日,50例患者完成巩固治疗(8个疗程化疗),26例患者完成维持治疗。完成8个疗程化疗的KRd+ASCT的患者CR率为72%,而KRd化疗组为30%。在完成全部18个疗程的患者中,KRd+ASCT组的CR率为88%,KRd化疗组为51%。KRd+ASCT组中位随访17.8个月,2年PFS率为99%;KRd化疗组4年PFS率为69%。虽然该研究不是随机对照研究,但是ASCT的加入,显著提高了患者的CR率和PFS率。
另外有研究显示,ASCT作为一线治疗选择,不仅可显著延长患者的PFS期和OS期,而且,那些接受一线ASCT治疗的患者,在疾病进展接受二线治疗后,再次进展和死亡的风险明显低于未接受ASCT治疗的患者,同时也低于将ASCT作为挽救治疗的患者。一项大规模的Meta分析显示,在ASCT后采用来那度胺维持治疗,同样也能够显著地延长患者的OS。
MM的中位OS期由十几年前的18个月已经上升到现在的62个月。相信随着新药及免疫治疗的不断涌现,新的治疗策略不断改进,在显著延长生存期的同时,也能有效改善患者的生命质量,为MM患者带来更多的临床获益,使其成为继慢性粒细胞性白血病之后的慢性疾病,最终获得临床治愈。
来源:白血病·淋巴瘤,2016,25( 8 ): 449-453
作者:哈尔滨血液病肿瘤研究所 赵东陆,马军
声明:本网注明来源的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们(vdoctor@126.com)。