您的浏览器太旧了,请更新您的浏览器X
肿瘤
免疫治疗在肿瘤治疗中日益受到重视,包括免疫治疗药物和细胞免疫疗法,虽然以化疗为主的免疫治疗药物完全缓解率较高,但是仍有20%~30%患者死于肿瘤耐药所致的复发和难治。近年来肿瘤细胞免疫治疗成为最活跃、最有发展前途的一种治疗手段。包括细胞因子诱导杀伤细胞疗法、树突状细胞疗法等,但大多数肿瘤细胞不断表达自体抗原,使靶向这些抗原的T细胞通过免疫耐受机制被中和或移除,难成为主流细胞治疗技术。临床上把目光投向嵌合抗原受体T细胞(CAR-T)免疫疗法,这种利用基因工程改造CAR-T,是非主要组织相容性复合体(MHC)依赖的肿瘤特异性杀伤细胞,它具有高效率和持久性。
2014年7月美国食品和药物管理局(FDA)通过瑞士诺华公司开发的个性化CAR-T疗法CTL019突破性药物认证,推动这种疗法的研究。2015年10月中国CAR-T多中心临床研究项目正式启动。该项目在18家医院成立了临床研究中心,目的是为了评价CAR-T技术治疗复发难治性血液肿瘤的安全性和临床有效性,为更广泛的应用于临床治疗提供依据。
一、CAR-T基本介绍及实现原理
CAR-T疗法是嵌合抗原受体T细胞免疫疗法,利用基因技术研究改造T细胞,基本过程是将识别肿瘤相关抗原(TAA)的单链抗体(scFv)和T细胞的活化序列在体外进行基因重组,形成重组质粒,在体外通过转染技术,大规模扩增T细胞。
临床上根据对CAR-T的不同修饰方法将其分为3代。第一代CAR将免疫球蛋白样scFv和FcεRI受体(γ链)或CD3复合物(ζ链)胞内结构域融合形成嵌合受体,由单链抗体通过跨膜区域与胞内信号转导区(ITAM)相连。CAR表达的稳定性依赖于所用的胞内信号依照T细胞活化的双信号学说。第二和第三代CAR在嵌合受体上引入共刺激分子(CM),以提高T细胞的细胞毒性及增殖活性、维持T细胞应答、延长T细胞存活时间等。其中第二代CAR的胞内信号转导区引入了CM,主要为CD28分子;第三代CAR引入了双CM,主要为CD28分子加上CD134或CD137(图1)。
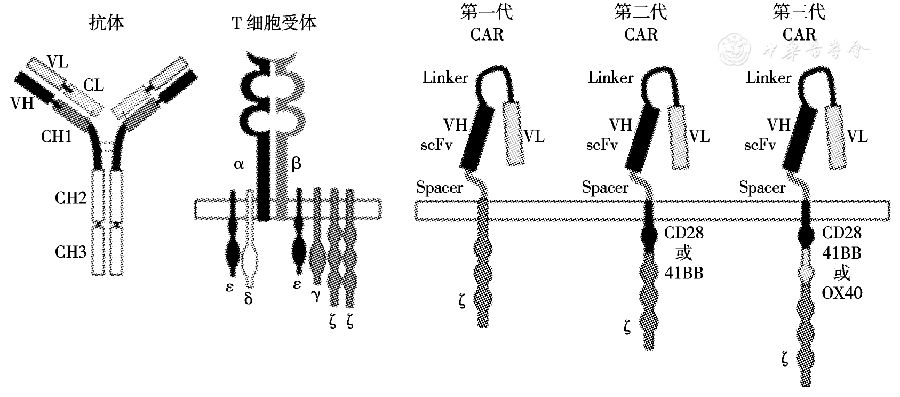
图1 第一代至第三代嵌合抗原受体(CAR)示意图
CAR-T发展方向的研究将集中于设计更安全的第四代CAR、甄选具备最佳治疗潜质的T细胞亚群。Kebriaei等于2012年阐述了如何从同种异体分离T细胞并转染和筛选出CAR+ T细胞。2013年Singh等阐述了如何利用Sleeping Beauty system和人工抗原提呈细胞的方法制造出CAR表达率>95%转染的T细胞,这种标准化的方法可为今后临床注射应用提供稳定可靠的修饰T细胞。未来CAR-T治疗将集中于优化临床治疗方案、完善临床前试验模型等方面。
二、CAR-T技术临床应用
CAR-T在白血病、淋巴瘤、黑色素瘤、脑胶质瘤等恶性肿瘤治疗中均显示出良好的抗肿瘤效应,尤其是在白血病和淋巴瘤中。由于大多数B细胞恶性肿瘤表达CD19抗原,而多数B细胞恶性肿瘤应用现有方法难以治愈,CAR为解决这一问题提出了新思路。
1. 白血病
CAR-T疗法对于复发性急性淋巴细胞白血病(ALL)是一种非常有前途的细胞免疫治疗方式。通过对T细胞进行离体基因修饰和扩增,培养出足够剂量的免疫细胞。尽管这些年在治疗急性髓系白血病(AML)时化疗和骨髓移植均取得进展,但还是有很多患者死于复发和病情恶化,研究发现AML患者对T细胞介导的异基因造血干细胞移植敏感。随着CAR-T疗法的出现,用过转染方式建立T细胞,表达CAR,可以针对已知的肿瘤相关抗原,对AML显示出积极的疗效。Ritchie等研究评价第二代CAR-T对AML的效果,通过对患者外周血和骨髓的PCR分析证实CAR-T持续存在10个月。4例患者均出现不同程度的疗效,研究证实了T细胞治疗高危AML的可行性和安全性,并证实了其持久性。
还有一项针对青少年ALL患者进行的Ⅰ期临床试验,研究20例复发性或难治性B前体细胞ALL(B-ALL)患者(年龄1~ 30岁),评估CAR-T疗法的给药、应答以及毒性。10例微小残留病变(MRD)阴性患者接受了同种异体造血干细胞移植(SCT),并在10个月中位随访期内保持缓解。6例患者发生3~ 4级细胞因子释放综合征,给予抗白细胞介素-6治疗。2011年Porter等使用慢病毒作为载体转染T细胞,设计嵌合抗原受体T细胞,针对B细胞抗原CD19,其中CD137和CD3分子作为信号转导域,治疗慢性淋巴细胞白血病(CLL),注射后淋巴结消融,病情持续缓解10个月。2013年Kochenderfer等使用了来自于异体造血干细胞捐献者改造的anti-CD19 CAR-T,用于移植后B细胞恶性肿瘤的治疗,结果表明供体改造的同种异体T细胞使B细胞恶性肿瘤缓解,其中1例CLL患者获得持续完全缓解。
目前国内也已开展相关治疗及临床评价的研究,其中中国医学科学院北京协和医学院血液病医院研发的CAR-T19和CAR-T33两项技术成熟,分别在体内、外进行白血病细胞杀伤实验,证明CAR-T19及CAR-T33细胞对表达CD19、CD33抗原的白血病细胞具有很强的杀伤效应,已申报相关专利。
2. 淋巴瘤
2010年首次报道anti-CD19 CAR-T治疗应用于临床,并取得良好效果,选取1例晚期淋巴瘤患者并经过治疗达到缓解期,通过注射anti-CD19 CAR-T,使患者长期处于淋巴瘤缓解期,其中正常的CD19+ B细胞也长期被根除,表明anti-CD19 CAR-T发挥作用。Mihara等研究了anti-CD19 CAR-T和anti-CD38 CAR-T联合利妥昔单抗对非霍奇金淋巴瘤的疗效,发现经体外改造的T细胞对非霍奇金淋巴瘤有很强的细胞毒作用,并且可持续超过2个月。
3. 黑色素瘤
CAR-T疗法在黑色素瘤中也显示出巨大的应用价值,2006年就已经开始有黑色素瘤患者接受临床试验。此试验包括17例转移性黑色素瘤患者,其中2例患者病情完全控制,并在18个月内没有复发。2011年Rosenberg等报道了CAR-T疗法治疗转移黑色素瘤患者使其症状得到改善,93例患者中有20例完全缓解,3年和5年的生存率分别为36%和29%,证明这种方法治疗黑色素瘤有效。
三、CAR-T技术的发展及挑战
CAR-T也存在局限性,这种技术风险高,是定制疗法,临床花费较大。CAR-T不仅会杀灭癌细胞,还会摧毁其他相关表达细胞,例如B细胞,患者可能一直需要持续注射丙种球蛋白。细胞因子风暴也是问题之一,2010年报道1例结肠癌合并肝和肺转移患者在输注后4 h血液就检测出有高水平的干扰素γ、肿瘤坏死因子α和IL-6等细胞因子,CAR-T注射后,识别并攻击相关表达的正常肺细胞,释放出大量细胞因子,患者经过5 d抢救后死亡。其次CAR-T技术在实体瘤治疗方面不佳,但有报道通过改造和基因修饰PD1CD28信号通路可以增强CAR-T活性,通过多种机制有效对抗实体肿瘤,目前这种潜在的治疗方法正在进行临床研究。
在CAR-T治疗领域,重点发展CAR-T专用的单链抗体制备技术、第四代CAR-T技术、慢病毒和非病毒表达技术、以中心记忆T细胞为主要表型CAR-T的高效/经济制备技术。目前已制备好可应用于白血病、淋巴瘤、多发性骨髓瘤、胃癌、肠癌、肺癌、乳腺癌、胰腺癌等多种适应证的CAR-T技术体系。免疫治疗是目前治疗恶性肿瘤及其他疾病的重要辅助方法,目前CAR-T技术的临床应用为肿瘤的免疫治疗及其他疾病的治疗提供了有力方法,特别是随着更多肿瘤靶点的开发及技术改进,使CAR-T技术成为主流细胞治疗手段。这一技术将会在一些疾病的发生、发展机制以及预防治疗中发挥重要作用。
来源:白血病·淋巴瘤 2016,25(10):629-632
作者:师越 廖晓龙
声明:本网注明来源的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们(vdoctor@126.com)。